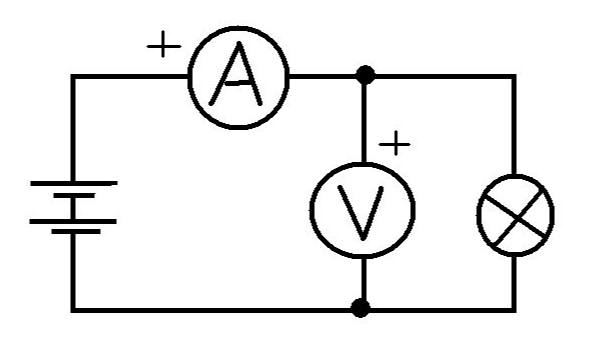
电化学电池
原电池将化学能转化为电能,将电能转换为化学能。每个电化学电池由称为电极的两个导体和与其接触的电解质溶液组成。
与其接触的电极和电解质溶液形成半电池,并且两个半电池构成电化学电池。在电化学电池中,经历氧化反应的电极称为阳极,经历还原反应的电极称为阴极。
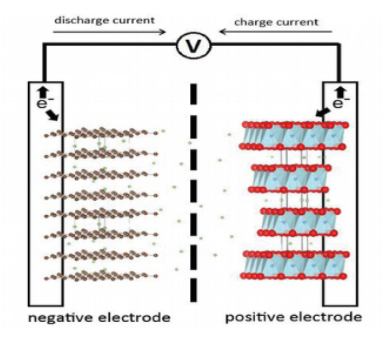
在右边所示的铜 - 锌一次电池中,阳极和阴极上发生的氧化还原反应如下:阳极(锌电极,负电极):Zn-2e→Zn2 +阴极(铜电极,正电极):Cu2 + + 2e→Cu锌电极发生氧化反应,锌棒上的Zn原子从固相进入液相,成为Zn2 +;铜电极发生还原反应,溶液中的Cu2 +从液相进入固相,成为Cu原子。通过连接两个电极的外部电路引线来完成电子的转移和转移。
因为电子从锌极流到铜极,所以铜极为正极,锌极为负极(电极的“阴”和“阳”根据电极的反应特性确定;根据电极电位确定电极的“正”和“负”。在电池内部,两种电解质溶液与KCL盐桥接触。
当电极经历氧化还原反应时,ZnSO 4烧杯中的溶液富含正电荷,并且CuSO 4烧杯中的溶液富含负电荷。此时,盐桥中的Cl-迁移到ZnSO4溶液中,K +迁移到CuSO4溶液中,从而形成电流回路。
。一次电池的总反应为:Cu2 ++ Zn→Cu + Zn2 +。
根据习惯,阳极和与其接触的溶液写在左侧,阴极相关部分写在右侧;半单元中的相界面在单个垂直线中。 “|”表示两个半电池通过盐桥连接,双垂直线“U”;溶液表示活性(浓度),气体表示压力。
除非另有说明,否则温度指的是25°C。铜锌一次电池的符号可表示为:(1)Zn | ZnSO4(1mol / L)UCuSO4(1mol / L)| Cu(+)如果施加的电压大于电动势的电动势原电池,铜锌原电池成为电解槽:阳极(铜柱,正极):Cu-2e→Cu2 +阴极(锌电极,负极):Zn2 ++ Cu→Zn电解槽的总反应为: Zn2 ++ Cu→Zn + Cu2 +上述反应是铜锌一次电池反应的逆反应。
显然,原电池的电池反应自发进行;电解槽的电池反应不能自发地进行。潜在方法中使用的测量电池都是原电池。
当使具有不同组成或不同浓度的两种电解质溶液接触以形成界面时,在界面两侧产生的电位差被称为液体结电势,称为液体结电势,并且被称为作为Ej。溶液中离子的不同扩散速率是液体结电位的主要原因。
根据实际测量,当0.1mol / L的HCL(I)与0.01mol / L的HCL(II)接触时(如右图a所示),Ej约为40mV。由于Ej难以精确测量,通过电位测量法测量的电化学电池大多是液体连接电池,因此有必要尝试消除或减少Ej的影响。
通常的做法是在填充有高浓度KCL(或其他合适的电解质)溶液的两个电极溶液之间放置盐桥。由于K +和Cl-的扩散速率非常接近,当盐桥与浓度较低的电解质溶液接触时,压倒性的扩散将是III相的K +和Cl-相进入I相和相。
II几乎同时(例如右)。图b),这使得Ej很小(1~2mV),这通常可以忽略不计。
在该方法中,盐桥具有以下功能:分离正负双电极电解质溶液以避免彼此混合;传达内部电路;消除或降低液体结电势;保护参比电极免受来自测试溶液的液体填充。为了使电极电位恒定。
盐桥的一般条件是:1盐桥中正离子和负离子的扩散速率大致相等; 2当浓缩溶液与电解质溶液接触时,盐桥中的正离子和负离子主要扩散; 3不与构成电池的溶液反应,例如在Ag +溶液中,KCL不能用作盐桥(可选KNO3)。